无机化学家张青莲院士
7月31日是我国著名无机化学家、教育家,中国稳定同位素学科的奠基人和开拓者,中国科学院院士、北京大学化学系教授张青莲110周年诞辰日。小编在这里整理了张青莲相关资料,希望能帮助到您。
无机化学家张青莲院士
张青莲(1908.7.31—2006.12.14)出生于常熟市支塘镇的一个小康之家。六岁时,张青莲进支塘小学读书。14岁时,考入苏州桃坞中学。1930年,从光华大学化学系毕业后,曾在常熟孝友中学任教一年。 1931年,考取清华大学研究生院。 1934年,进入柏林大学物理化学系学习。1936年获柏林大学博士学位后,到瑞典物理化学研究所做访问学者。1937年回国后,历任光华、西南联大、清华、北大等大学教授。1955年当选为中国科学院学部委员(院士)。1981 -1992年任中国科学院化学学部副主任。曾任中国质谱学会首届理事长,国家科委稳定同位素分组组长、国际纯粹与应用化学联合会原子量与同位素丰度委员会衔称委员等。
张青莲学识渊博,兴趣广泛,治学严谨,宽以待人,桃李满天下。 他一生始终遵循他自已的信条,为祖国的科研与教育事业做出了许多贡献。1989年,中国科学院授予他“从事科学工作五十年”的荣誉奖状。1990年,化工部为表彰张青莲对重水生产的功绩,授予他“全国国防化工先进工作者”称号。 他主持测定的铟、铱、锑、铕、铈、铒、锗、锌、镝等十种元素的相对原子量新值,被国际原子量委员会采用为国际新标准。2000年,张青莲作为中国两位杰出的化学家之一,入选人教版全日制高中化学教科书。
2011年11月,家乡常熟为了纪念这位著名的化学家,将常熟市支塘中心小学更名为常熟市张青莲小学,中国科学院院长白春礼为新校题写了校名。2018年7月,张青莲诞辰110周年之际,支塘镇党委、政府出资建办了张青莲事迹陈列馆,以最大的敬意来缅怀这位支塘骄子。
在纪念张青莲诞辰110周年报告会和纪念张青莲诞辰110周年座谈会上,来自北京大学化学与分子工程学院、中国质谱学会的相关领导、专家、教授等通过珍贵的影像资料、专家学者精彩的讲话和报告,追忆了张青莲孜孜不倦、献身科学的爱国品行;重温了张青莲创新进取、勇攀高峰的科学精神。支塘镇党委书记董国新表示,我们举办系列纪念活动,缅怀先生生平,就是号召大家认真学习他爱国报国、追求真理、务实创新的科学精神,激励后人奋勇争先,在各自岗位上不断取得新的成绩。
高考化学元素周期律选择题
.
一、2014~2018五年大数据
此道选择题是高考理综化学必考题:
| 命题角度 | 设项方向 | 频数 | 难度 |
| 1.核外电子排布规律与元素(物质)性质 | ①非金属(金属)性比较 ②原子(离子)半径比较 ③单质、氢化物熔、沸点比较 ④离子键与共价键判断 ⑤离子化合物与共价化合物判断 ⑥物质性质判断 | 11 | 0.51 |
| 2.元素周期表片段 | 1 | 0.58 | |
| 3.物质转化与元素推断的融合 | 1 | 0.49 |
二、备考策略
本题型以短周期主族元素的推断为载体、考查元素周期律的应用。内容涉及元素原子半径大小的比较、金属性强弱的判断、金属氧化物的水化物的碱性强弱判断及非金属元素单质氧化性的比较等知识点。
主要考查考生对元素周期表中元素原子结构和元素性质周期性变化规律的理解,要求考生对“位-构-性”有充分的认识,并将周期表、原子的电子层结构、元素单质及其化合物的性质等内容结合起来进行综合运用。只有推断出相关元素的名称并熟悉它们所形成的单质及其化合物的化学性质,才能得出正确结论。
预计2019年高考还会以考查递变规律和性质为主,题目一般通过图表、文字或相关数据分析等推断同主族、同周期元素性质的递变规律,或以陌生元素在元素周期表中的位置,推断其可能具有的性质等,有时还通过简单的实验设计或现象推断性质递变规律或元素金属性或非金属性的强弱等。
全国卷中此类选择题是必考题,截止目前出现的一些新的动向:
1、推断出的元素是不确定的。
2、涉及到氢负离子——H—,H—与Cl—还原性的比较。
3、单质的熔沸点比较,要补充一些物构中晶体的知识。
4、陌生的物质的出现,如:CaF2与浓硫酸反应生成HF。
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O。其实这一物质在2014年高考中就大规模出现过。
5、有小题大做的可能,如2016年与框图有机推断结合。
三、考点突破
考点一:化学键与物质类别
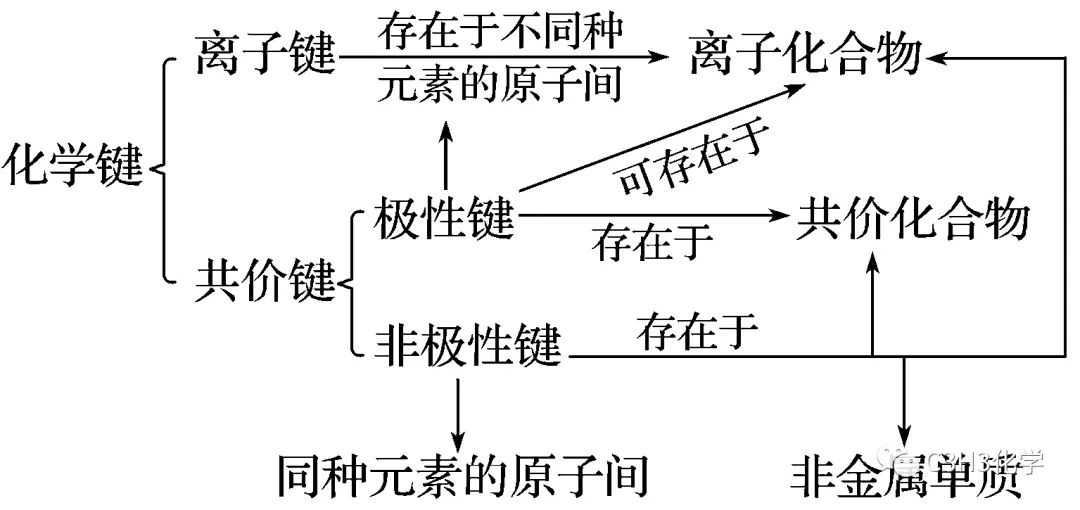
判断:
(1)Na2O和Na2O2所含化学键类型完全相同(×)
(2)NaOH和Na2O2所含化学键类型完全相同(×)
分析:
(1)中Na2O2含有共价键而Na2O中没有;
(2)Na2O2中含离子键和非极性共价键,NaOH中含离子键和极性共价键,共价键类型不同。
考点二:元素周期表
1.元素分布特点
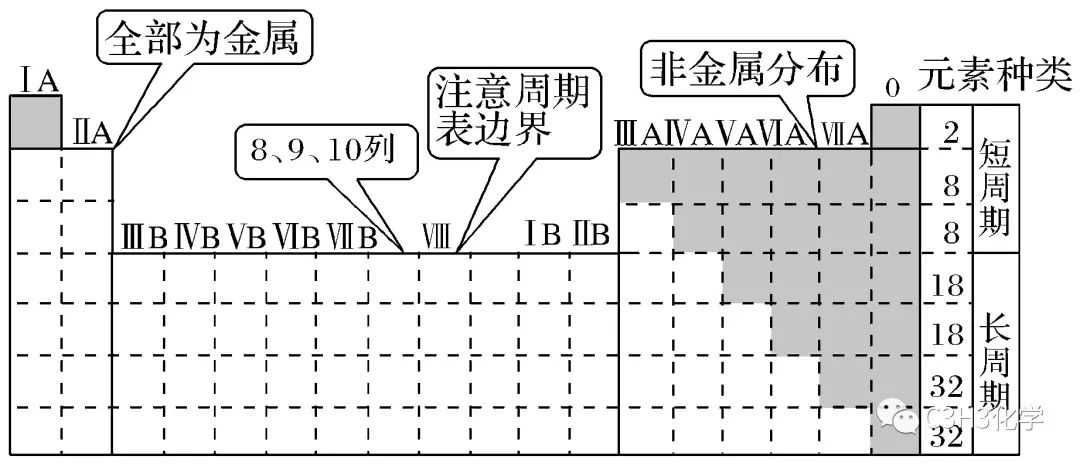
可以让学生画出上面的周期表,标出1—36号元素与主族元素。
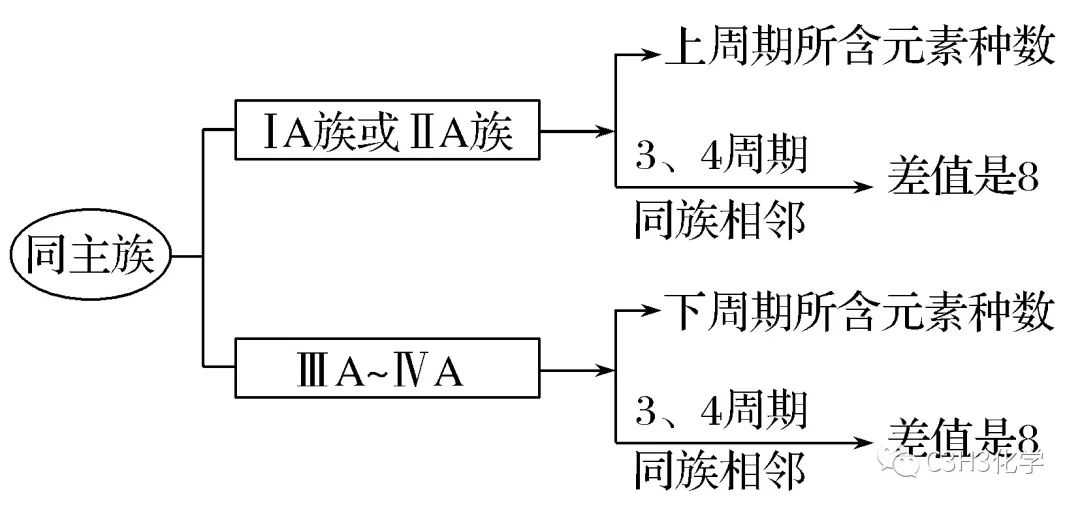
2.元素的位置关系和原子序数关系的应用
(1)同一周期中相邻元素的原子序数一般比左边元素原子序数大1,比右边元素的原子序数小1。
(2)同主族上下周期元素的原子序数关系的应用。
考点三:三大高频规律
| 规律 | 比较方法 |
| 金属性与非金属性 | 元素金属性、非金属性强弱的本质 原子越易失去电子,金属性就越强;原子越易得电子,非金属性就越强;即元素非金属性和金属性的强弱,取决于其原子得失电子的难易程度 |
| 判断元素金属性、非金属性强弱的事实依据: 1.置换反应:强的置换弱的,适合金属也适合非金属。 2.与水或酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强。 3.与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越强 | |
| 原子或 离子半 径比较 | #FormatImgID_3# |
| 熔、沸点 比较 | 1.根据物质状态判断 即物质沸点高低按常温下的状态:固体>液体>气体。 如:NaCl>H2O>CO2 2.根据物质不同结构特点判断 一般情况下:原子晶体(金刚石、二氧化硅)>离子晶体(NaCl、K2S)>分子晶体(硫、干冰) |
| 3.分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4<SiH4<GeH4<SnH4 (2)因为氢键>范德华力,所以存在分子间氢键的物质沸点高于由只存在范德华力的物质。如:乙醇>氯乙烷;HF>HCl |
考点四:常考11中元素推断
| 元素 | 排布特点(结构特征) | 性质特征 |
| H | ①最外层只有一个电子 ②族序数等于周期数 ③无中子 ④半径最小 | ①密度最小的单质 ②宇宙含量最多的元素 |
| Li | ①周期数是族序数2倍的元素 ②最外层电子数是内层电子数的一半 | 电极材料 |
| C | ①族序数等于周期数2倍的元素 ②最高正价与最低负价代数和为零的短周期元素 | ①形成化合物种类最多的元素 ②单质是自然界中硬度最大的物质 ③元素或气态氢化物中氢的质量分数最高的元素 |
| N | ①空气中含量最多的元素 ②气态氢化物的水溶液呈碱性的元素 ③元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应 ④某一氢化物可做液态燃料 ⑤常见氢化物可做制冷剂 | |
| O | ①族序数等于周期数3倍的元素 ②最外层电子数是最内层电子数的3倍 ③最外层电子数是电子层数的3倍 ④最高正化合价不等于族序数的元素 | ①地壳中含量最多的元素 ②氢化物在通常情况下呈液态的元素 ③某一单质可杀菌、消毒、漂白 |
| Na | ①周期数是族序数3倍的元素 ②原子半径最大的短周期元素 ③L层电子数为8,与H同主族的元素 | ①短周期中金属性最强的元素 ②元素的单质在常温下能与水反应放出气体的短周期金属元素 ③两种最常见氧化物的水化物皆呈碱性的短周期元素 |
| Al | 族序数等于周期数的元素 | ①最高价氧化物及其对应的水化物既能与强酸反应,又能与强碱反应的元素 ②氧化物可做耐火材料 ③地壳中含量最多的金属元素 |
| Si | ①最高正价与最低负价代数和为零的短周期元素 ②最外层电子数是次外层电子数的一半 | ①单质是重要的半导体材料 ②氧化物可用作光导纤维 ③最高价非金属氧化物对应的水化物难溶于水 |
| P | 最外层电子数是内层电子数的一半 | ①组成骨骼和牙齿的必要元素 ②某一单质和其氢化物都能自燃 |
| S | ①族序数等于周期数2倍的元素 ②与氧同主族的短周期元素 ③最外层电子数是电子层数的2倍 | ①某一氧化物可做漂白剂和防腐剂 ②最高价氧化物的水化物是常见的干燥剂 ③元素的氢化物和它的最高价氧化物对应的水化物可发生氧化还原反应 |
| Cl | 第三周期主族元素原子半径最小 | ①最高价氧化物对应的水化物酸性最强 ②单质可用作自来水的杀菌消毒 ③与同周期半径最大的金属组成的化合物溶液呈中性 |
考点五:常见化合物转化
常见的转化关系总结
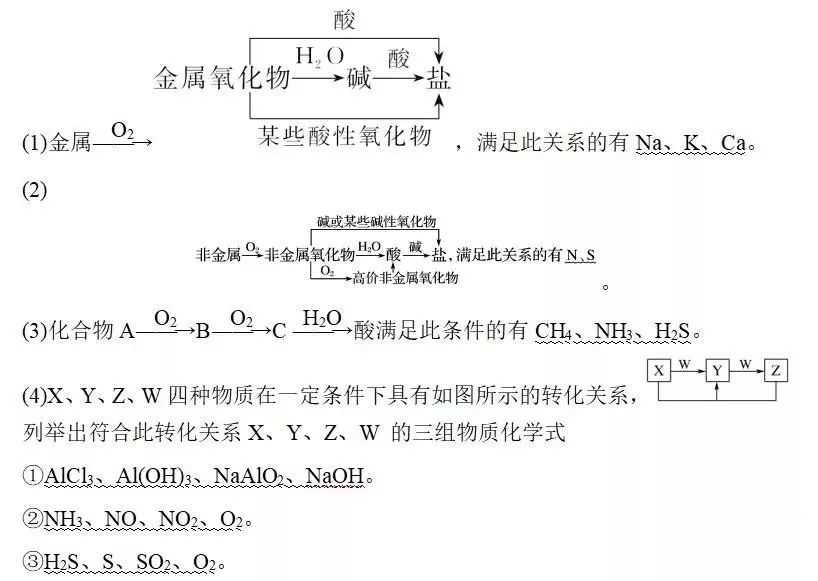
列举出符合此转化关系A、B、D、E 的三组物质的化学式
①Fe、Fe(NO3)3、Fe(NO3)2、HNO3。
②CuO、CO、CO2、C。
③NaOH、NaHCO3、Na2CO3、CO2。
(6)R、X、Y、Z是原子序数依次增大的短周期元素,a、b、c、d分别是这4种元素的单质。已知:Y是地壳中含量最高的金属元素。向甲的溶液中通入丙气体,产生白色沉淀,它们之间的转化关系如图所示。
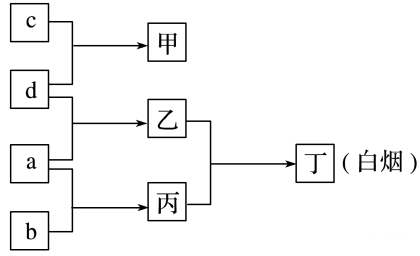
判断:R、 X、 Y、 Z分别为(元素符号)H、N、Al、Cl。
甲、乙、丙分别为(化学式)AlCl3、HCl、NH3。
无机化学家张青莲院士
上一篇:著名化学名著《大众化学化工史》
下一篇:返回列表